Perché...?
Perché cortisone aumenta glicemia: rischi, sintomi, rimedi
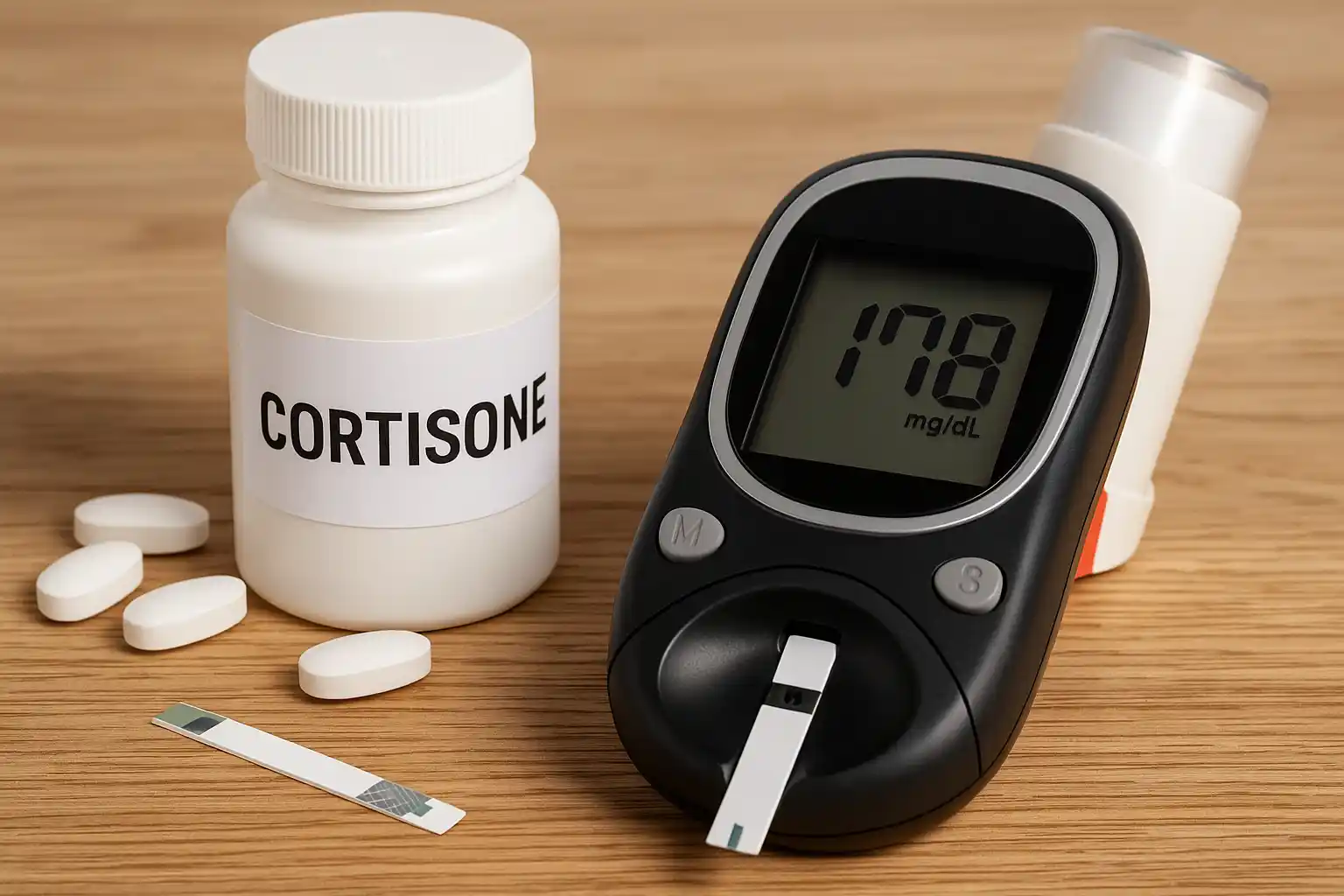
Perché cortisone aumenta glicemia rischi e come gestire i valori alti con consigli pratici, monitoraggio mirato e terapie su misura efficaci.
Il cortisone è uno dei farmaci più prescritti in Italia per bronchiti, riacutizzazioni di asma o BPCO, malattie reumatologiche, allergie importanti, patologie autoimmuni, fino alle terapie oncologiche. Quello che molti pazienti scoprono solo dopo la prima terapia è che, nel giro di pochi giorni, lo zucchero nel sangue inizia a salire in modo netto. L’effetto non è casuale: i glucocorticoidi sono ormoni che, per come agiscono sull’organismo, spingono la glicemia verso l’alto aumentando la produzione di glucosio da parte del fegato, riducendo la sensibilità all’insulina e modificando il metabolismo di grassi e proteine.
Per capire davvero perché cortisone aumenta glicemia, bisogna leggere questo farmaco non solo come un potente anti–infiammatorio, ma come un regolatore del metabolismo che mette il corpo in una sorta di “modalità emergenza”. Lo zucchero nel sangue sale perché il corpo, sotto l’effetto del cortisone, si comporta come se fosse sotto stress continuo: rilascia più glucosio nel circolo sanguigno e allo stesso tempo lo fa usare meno bene a muscoli e tessuto adiposo. Il risultato è una iperglicemia da cortisone che può essere temporanea e reversibile, ma in una quota non trascurabile di persone evolve in un vero diabete steroideo, cioè un diabete scatenato o svelato dalla terapia con glucocorticoidi. Studi recenti indicano che i glucocorticoidi sono coinvolti in circa il 2% dei nuovi casi di diabete nella popolazione generale e che l’iperglicemia indotta può interessare fino a un terzo dei pazienti esposti a determinate dosi.
In Italia questo tema è sempre più rilevante: il cortisone resta un farmaco indispensabile, spesso insostituibile, ma la gestione del suo impatto sulla glicemia è entrata stabilmente tra le priorità di diabetologi, internisti, reumatologi e medici di medicina generale. Capire cosa succede, chi è più esposto e come difendersi è il primo passo per usare il cortisone in sicurezza, senza sottovalutare i rischi ma neppure demonizzare un presidio terapeutico fondamentale.
Come il cortisone altera la glicemia: il quadro generale
Il cortisone appartiene alla famiglia dei glucocorticoidi, ormoni che l’organismo produce naturalmente sotto forma di cortisolo. Il loro nome dice già molto: “gluco” rimanda al glucosio, lo zucchero principale del sangue. Quando vengono somministrati come farmaci, i glucocorticoidi amplificano la risposta allo stress del corpo: aiutano a ridurre infiammazione, dolore, reazioni autoimmuni, ma in parallelo rimodellano il metabolismo degli zuccheri. Questo spiega perché l’aumento della glicemia non è un effetto collaterale bizzarro, bensì un effetto prevedibile della terapia.
In condizioni normali, l’organismo mantiene la glicemia entro margini stretti grazie all’azione coordinata di insulina e glucagone, al lavoro del fegato e alla capacità di muscoli e tessuto adiposo di assorbire lo zucchero dopo i pasti. Il cortisone interviene proprio su questi equilibri: spinge il fegato a produrre nuovo glucosio, diminuisce la risposta dei tessuti all’insulina e sposta parte delle riserve di grasso verso il distretto addominale, metabolicamente più “pericoloso”. Il risultato pratico è che, dopo pochi giorni di terapia a dosi medio–alte, molti pazienti registrano valori di glicemia più elevati al pomeriggio e alla sera, soprattutto dopo pranzo, rispetto a quanto avveniva prima della cura.
Le casistiche internazionali mostrano che l’iperglicemia da glucocorticoidi può riguardare circa il 30% dei ricoverati esposti a steroidi sistemici, con un’incidenza di diabete indotto o svelato che in alcune metanalisi supera il 18% nei trattamenti prolungati. Non significa che una persona su cinque in terapia con cortisone diventerà diabetica per sempre: in molti casi, alla sospensione del farmaco la glicemia rientra. Ma questi numeri chiariscono perché i valori di zucchero nel sangue non possano essere ignorati durante una cura steroidea, soprattutto in chi ha già un equilibrio glicemico al limite.
L’aumento della glicemia non è solo un problema di “numeri brutti” sul glucometro. Nei pazienti ricoverati, l’iperglicemia è associata a rischio più alto di infezioni, degenza più lunga e prognosi peggiore, anche in chi non aveva una diagnosi di diabete prima del ricovero. Per questo le principali linee guida internazionali raccomandano oggi di considerare sempre il rischio di iperglicemia quando si prescrive un glucocorticoide, adeguando il monitoraggio e, quando serve, intervenendo con una terapia specifica.
Cosa succede nel corpo: fegato, muscoli, tessuto adiposo
Per capire davvero perché cortisone aumenta glicemia, è utile entrare nel dettaglio di cosa accade ai principali organi coinvolti nel metabolismo del glucosio.
Il fegato è il primo attore di questa storia. In presenza di glucocorticoidi, aumenta la produzione di glucosio attraverso la gluconeogenesi, cioè la sintesi di nuovo zucchero a partire da aminoacidi e altre molecole, e accelera la glicogenolisi, la liberazione di glucosio dalle sue riserve interne. Il cortisone, in pratica, dà un ordine netto: “Rendi disponibile più energia nel sangue, perché potrebbe servire a fronteggiare uno stress importante”. Il problema è che questa “modalità emergenza” viene mantenuta anche se la persona è semplicemente seduta sul divano o in ufficio, senza alcuna reale necessità di maggiore glucosio.
I muscoli rappresentano il principale utilizzatore di glucosio dopo i pasti. L’insulina, secreta dal pancreas, agisce come una chiave: apre dei canali (i trasportatori GLUT4) che permettono al glucosio di entrare nelle cellule muscolari. Il cortisone rende questa chiave meno efficace, riducendo la capacità dei muscoli di “pulire” il sangue dallo zucchero dopo i pasti. È la classica insulino–resistenza indotta da glucocorticoidi: l’insulina è presente, talvolta addirittura in quantità aumentata, ma non riesce a svolgere il suo compito in modo efficiente.
Il tessuto adiposo completa il quadro. Sotto l’effetto del cortisone, aumenta la lipolisi, ovvero la liberazione di acidi grassi nel sangue. Nel medio–lungo periodo si assiste però a una redistribuzione del grasso verso il comparto viscerale (pancia, tronco, viso), tipica delle terapie steroidee a lungo termine. Gli acidi grassi in eccesso circolano, si accumulano in muscoli e fegato e rendono ancora più marcata l’insulino–resistenza, alimentando un circolo vizioso che spinge la glicemia verso l’alto.
C’è poi la funzione del pancreas, che prova a compensare. In molte persone le cellule beta pancreatiche rispondono alle prime settimane di terapia steroidea producendo più insulina, nel tentativo di contrastare l’aumento della resistenza. Se il pancreas è sano e ancora “elastico”, questa risposta può essere sufficiente e l’iperglicemia rimane contenuta. Se invece esistono fragilità pregresse – prediabete, familiarità, età avanzata – il pancreas non riesce a tenere il passo e comincia a emergere un profilo glicemico francamente diabetico. Alcune ricerche suggeriscono che i glucocorticoidi possano anche avere effetti diretti sulla funzione beta–cellulare, riducendone la capacità di secrezione in condizioni di stress prolungato.
Un elemento pratico importante, spesso sottovalutato dai pazienti, è il timing dell’iperglicemia da cortisone. Molecole come prednisone o metilprednisolone, assunte al mattino, tendono a far salire la glicemia soprattutto nelle ore centrali della giornata, con picchi tra il pranzo e la sera. Molecole a lunga durata d’azione, come desametasone e betametasone, possono invece mantenere la glicemia alta per gran parte delle 24 ore, con valori elevati anche a digiuno la mattina successiva. Questa dinamica aiuta a capire perché, in molti protocolli, i controlli glicemici sono raccomandati non solo a digiuno, ma anche 2 ore dopo i pasti principali, in particolare dopo colazione e dopo pranzo.
Chi è più vulnerabile all’aumento di glicemia
Non tutti i pazienti reagiscono allo stesso modo al cortisone. Esistono profili di rischio ben chiari che rendono più probabile un aumento marcato della glicemia o l’insorgenza di un vero diabete da cortisone.
Il primo fattore è la presenza di un diabete già noto. In chi è già in cura per diabete di tipo 2, o di tipo 1, il cortisone tende quasi sempre a peggiorare il controllo glicemico. Le stesse dosi di ipoglicemizzanti orali o di insulina che funzionavano bene prima della terapia steroidea diventano improvvisamente insufficienti: i valori si impennano, soprattutto dopo i pasti, e costringono a rivedere rapidamente la terapia. Le principali società scientifiche raccomandano, in questi casi, di programmare fin dall’inizio una strategia di aggiustamento del trattamento insieme al diabetologo o al medico curante, evitando improvvisazioni.
Altro gruppo a rischio è quello delle persone con prediabete o glicemia “borderline”, magari con emoglobina glicata poco sopra i limiti o con una precedente curva da carico leggermente alterata. In questi pazienti il cortisone agisce come un “rivelatore” di fragilità: porta allo scoperto un problema metabolico che fino a quel momento era compensato. In diversi studi, chi presentava già una ridotta tolleranza al glucosio prima della terapia aveva una probabilità nettamente maggiore di sviluppare un diabete steroideo durante o dopo il trattamento.
Il sovrappeso e l’obesità aumentano ulteriormente il rischio. Un indice di massa corporea elevato è quasi sempre sinonimo di insulino–resistenza di base: il cortisone, inserito in questo contesto, aggiunge un ulteriore carico sul sistema, rendendo la comparsa di iperglicemia molto più probabile. Lo stesso vale per la familiarità per diabete e per le donne con una storia di diabete gestazionale, che rappresentano già una popolazione “a sorveglianza intensiva”.
Conta anche l’età. Nel paziente anziano, il pancreas è meno flessibile nel rispondere agli stress metabolici, e la massa di cellule beta residue è spesso ridotta. Non sorprende che, nelle coorti osservazionali, l’incidenza di iperglicemia da cortisone risulti più alta nelle fasce d’età avanzate, soprattutto in presenza di altre comorbidità cardiovascolari.
Infine, un ruolo cruciale è svolto da dose, durata e modalità di somministrazione della terapia. Le terapie brevi a basse dosi hanno un impatto glicemico generalmente limitato; le terapie a dosi medio–alte prolungate per settimane o mesi sono il terreno su cui il rischio di diabete steroideo cresce in modo significativo. Anche i famosi “cicli a scalare”, usati in reumatologia o pneumologia, possono comportare settimane di esposizione significativa, sufficiente a far emergere un problema glicemico prima latente.
Tipi di cortisone, dosi, durata: perché non è sempre uguale
Quando si parla di cortisone, non si sta parlando di una sola molecola. Prednisone, metilprednisolone, desametasone, betametasone, idrocortisone: ciascuno di questi farmaci ha potenza, durata d’azione e indicazioni cliniche diverse, e questo incide direttamente anche sull’effetto sulla glicemia.
I glucocorticoidi a durata intermedia, come prednisone e metilprednisolone, sono tra i più usati in Italia per trattare riacutizzazioni respiratorie, malattie reumatologiche o allergiche. Assunti al mattino, raggiungono il picco d’azione nelle ore centrali della giornata e tendono a far salire la glicemia soprattutto tra pranzo e sera. Questo spiega perché molti pazienti riferiscono valori quasi normali al mattino a digiuno, ma misurazioni nettamente alterate nel pomeriggio.
I glucocorticoidi a lunga durata, come desametasone e betametasone, hanno un effetto più prolungato sulle 24 ore. Possono indurre iperglicemia diffusa, con valori elevati sia a digiuno sia dopo i pasti. Sono spesso utilizzati in oncologia, in alcune forme di chemioterapia, nelle neoplasie ematologiche o in specifici protocolli neurologici. Qui il rischio di diabete steroideo è particolarmente rilevante perché le dosi sono spesso elevate e la durata della terapia non di rado è lunga.
La via di somministrazione pesa a sua volta. Il cortisone assunto per bocca o per via endovenosa ha effetti sistemici marcati sul metabolismo. Gli spray inalatori per asma e BPCO, pur essendo concepiti per agire localmente, possono dare effetti sistemici a dosaggi elevati o in trattamenti molto lunghi, soprattutto se associati ad altri fattori di rischio. Le infiltrazioni intra–articolari o peridurali possono provocare aumenti transitori della glicemia nei giorni successivi, più accentuati nei diabetici, ma di solito limitati nel tempo. Le forme topiche (creme, pomate) hanno un impatto sistemico minimo, salvo applicazioni molto estese o su cute danneggiata.
Non va dimenticato il tema della dose cumulativa. Studi di popolazione hanno mostrato che il rischio di sviluppare un diabete di tipo 2 aumenta in modo dose–dipendente con l’uso orale di glucocorticoidi: più lunga è l’esposizione e più alta la dose media, maggiore la probabilità che la glicemia si stabilizzi su valori patologici anche dopo la sospensione.
Questo non significa che ogni terapia con cortisone porterà necessariamente a un problema permanente. Ma rafforza l’idea che la prescrizione di glucocorticoidi non dovrebbe essere mai “automatica”: deve sempre accompagnarsi a una valutazione del rischio metabolico individuale, a una pianificazione del monitoraggio e, quando opportuno, a una consulenza diabetologica preventiva.
Strategie pratiche per tenere sotto controllo la glicemia
Una volta compreso perché cortisone aumenta glicemia, la domanda concreta per il lettore è: cosa si può fare, in pratica, per non farsi travolgere dai numeri sul glucometro?
Prima di tutto, entra in gioco il monitoraggio. Nei pazienti non diabetici che iniziano una terapia sistemica con cortisone, molte realtà italiane e internazionali suggeriscono di misurare la glicemia capillare a digiuno e 2 ore dopo i pasti principali nei primi 2–3 giorni di terapia, soprattutto se sono presenti fattori di rischio come sovrappeso, età avanzata o familiarità. Se i valori restano nella norma, si può poi diradare la frequenza dei controlli. Se invece compaiono ripetute misurazioni elevate, è opportuno avvisare il medico per valutare esami del sangue e possibili interventi.
Per chi ha già il diabete, il monitoraggio diventa più intensivo: spesso si passa a controlli più volte al giorno, con particolare attenzione ai picchi dopo pranzo e in serata, dove l’effetto del cortisone si fa sentire di più. In ospedale, le linee guida internazionali raccomandano di mantenere la glicemia, nella maggior parte dei pazienti non critici, tra circa 100–140 mg/dl prima dei pasti e sotto 180 mg/dl dopo, mentre nei pazienti critici il range accettabile si sposta tra 140 e 180 mg/dl per ridurre il rischio di ipoglicemie.
Sul fronte terapeutico, le strategie cambiano a seconda della situazione. Nei pazienti senza diabete preesistente e con modesta iperglicemia transitoria, spesso è sufficiente intervenire con alimentazione più controllata e un aumento mirato dell’attività fisica, se le condizioni cliniche lo consentono. Nei casi in cui la glicemia superi stabilmente determinate soglie, il medico può valutare l’introduzione temporanea di farmaci orali ipoglicemizzanti, come la metformina, o decidere di iniziare una terapia insulinica specifica per la fase di trattamento steroideo. Diversi protocolli propongono l’uso di insulina a durata intermedia (NPH) al mattino, calibrata sulla dose di cortisone e sul peso corporeo, proprio per coprire il picco glicemico delle ore centrali della giornata.
Per i pazienti che già usano insulina, l’arrivo del cortisone di solito richiede un aumento delle dosi o l’aggiunta di nuove somministrazioni. Una strategia frequente è aumentare la quota di insulina prandiale a pranzo e talvolta a cena, oltre a introdurre o potenziare la basale mattutina se la terapia steroidea è di tipo intermedio. Tutti questi aggiustamenti devono essere gestiti insieme al medico o al team diabetologico, perché il rischio, altrimenti, è di passare da picchi di iperglicemia a episodi di ipoglicemia quando il cortisone viene ridotto o sospeso troppo rapidamente.
L’aspetto alimentare non va trascurato. Non serve, nella maggior parte dei casi, passare a diete estreme, ma è utile ridurre nettamente gli zuccheri semplici (bibite zuccherate, succhi, dolci, snack industriali) nel periodo di terapia, preferendo carboidrati complessi a basso indice glicemico, come cereali integrali, legumi, verdure e frutta in quantità controllata. Suddividere meglio l’apporto di carboidrati nella giornata, evitando grandi carichi concentrati in un unico pasto, può contribuire ad attenuare i picchi di glicemia.
L’attività fisica, quando non controindicata dalla malattia per cui si assume il cortisone, resta un alleato importante: camminate regolari, cyclette leggera, esercizi di ginnastica dolce migliorano la sensibilità all’insulina e aiutano a smaltire il glucosio in eccesso. Naturalmente, nei pazienti con condizioni respiratorie acute, con forte astenia o in fase post–operatoria, ogni indicazione va personalizzata e concordata con il medico.
Un punto cruciale, spesso dimenticato per paura, è che non bisogna mai sospendere di colpo il cortisone di propria iniziativa solo perché la glicemia è salita. La terapia steroidea viene spesso prescritta per situazioni potenzialmente gravi, in cui l’interruzione brusca può avere conseguenze serie, anche sul piano endocrino (insufficienza surrenalica acuta). Il messaggio non è “smettere il cortisone per salvare la glicemia”, ma “gestire la glicemia per poter usare il cortisone in modo sicuro e mirato”.
Un equilibrio possibile tra benefici del cortisone e sicurezza metabolica
Alla fine, la vera questione non è se il cortisone faccia salire la glicemia – perché lo fa, e ora sappiamo con chiarezza perché – ma come far convivere i benefici di questi farmaci con la tutela del metabolismo degli zuccheri.
Le evidenze raccolte negli ultimi anni vanno tutte nella stessa direzione: l’iperglicemia da cortisone è frequente, talvolta silenziosa, ma gestibile se la si affronta con strumenti adeguati. Significa non considerare più i glucocorticoidi come semplici anti–infiammatori “potenti ma generici”, bensì come farmaci complessi, che richiedono una visione ampia del paziente: patologia di base, profilo metabolico, comorbidità, terapia in corso.
Per il lettore italiano questo si traduce in alcune scelte concrete. Informare sempre il proprio medico di eventuali precedenti di diabete, prediabete o glicemia alta prima di iniziare una terapia steroidea. Non sottovalutare segnali come sete intensa, aumento della diuresi, stanchezza marcata, vista sfocata durante il trattamento. Accettare l’idea di un monitoraggio glicemico più ravvicinato nelle fasi in cui la dose di cortisone è più alta, soprattutto se si rientra nelle categorie a rischio.
Dall’altra parte, il sistema sanitario – ospedali, ambulatori, medici di famiglia – sta progressivamente integrando protocolli dedicati all’iperglicemia indotta da steroidi, con algoritmi terapeutici specifici per il paziente reumatologico, oncologico, respiratorio. Il quadro scientifico si è fatto più chiaro: esistono strumenti efficaci per trattare questa forma di diabete “iatrogeno”, dall’aggiustamento mirato delle insuline alle combinazioni con farmaci orali, dalla gestione dei picchi post–prandiali alle strategie di de–scaling delle dosi quando il cortisone viene ridotto o sospeso.
Il messaggio chiave, per chi legge, è che comprendere perché cortisone aumenta glicemia non serve a creare allarme, ma a guadagnare controllo. Sapere che l’aumento dello zucchero nel sangue è un effetto atteso, legato a meccanismi precisi e studiati, permette di non viverlo come una sorpresa incomprensibile, ma come un segnale da monitorare e gestire insieme al proprio medico.
In molti casi, una volta terminata la terapia e riportata la dose di cortisone a zero o a livelli molto bassi, la glicemia tende a rientrare verso i valori di partenza. In altri, soprattutto se esisteva già una predisposizione, il diabete steroideo può diventare un diabete cronico da seguire nel tempo. Anche in questo scenario, però, aver intercettato il problema precocemente grazie al monitoraggio consente di intervenire prima che compaiano complicanze.
Il cortisone, insomma, resta un alleato importante in tante malattie, ma chiede in cambio rispetto e consapevolezza. Leggere il proprio referto glicemico con attenzione, parlare apertamente con il medico dei timori legati allo zucchero nel sangue, accettare eventuali modifiche temporanee di dieta e terapia: sono tutti tasselli di una stessa strategia. Una strategia che non mette in opposizione il bisogno di spegnere l’infiammazione con quello di proteggere il metabolismo, ma li tiene insieme, punto per punto, come fa ogni buona medicina centrata davvero sulla persona.
(Questo articolo ha scopo informativo e non sostituisce in alcun modo il parere del medico curante o dello specialista. In presenza di terapie con cortisone e alterazioni della glicemia, è sempre necessario confrontarsi con il proprio medico di riferimento.)
🔎 Contenuto Verificato ✔️
Questo articolo è stato redatto basandosi su informazioni provenienti da fonti ufficiali e affidabili, garantendone l’accuratezza e l’attualità. Fonti consultate: My Personal Trainer, Corriere della Sera, Centro Diagnostico Ippocrate, iDiabelogando, AIFA, ANIPI Puglia.


 Perché...?
Perché...?Perché la tempesta Kristin minaccia l’Italia dopo Portogallo e Spagna?

 Che...?
Che...?Esame di maturità 2026: quando escono le materie e che cambia

 Perché...?
Perché...?Perché Quartararo lascia Yamaha per Honda nel 2027?

 Domande da fare
Domande da fareTumore al pancreas: la cura spagnola funziona davvero?

 Che...?
Che...?Sport in TV il 29 gennaio: gli eventi da non perdere

 Quale...?
Quale...?PlayStation Plus di febbraio: quali giochi gratis puoi davvero scaricare?

 Perché...?
Perché...?Perché l’oroscopo di oggi 29 gennaio sorprende davvero?

 Domande da fare
Domande da fareAccadde oggi 29 gennaio: eventi chiave in Italia e nel mondo